柱式植物(wù)葉綠體提取試劑盒 (微量樣品)
|
産品編号
|
産品名稱
|
包裝
|
|
RTU5004
|
柱式植物(wù)葉綠體提取試劑盒
|
50次
|
● 産品簡介:
葉綠體(Chloroplast)是質體的一(yī)種, 是高(gāo)等植物(wù)和一(yī)些藻類所特有的能(néng)量轉換器(qì),是光(guāng)合作用的反應場所。在高(gāo)等植物(wù)中葉綠體為(wèi)雙凸或平凸透鏡,長(cháng)徑5~10μm,短徑2~4μm,厚2~3μm。高(gāo)等植物(wù)的葉肉細胞一(yī)般含50~200個(gè)葉綠體,可占細胞質的40%,葉綠體的數目因物(wù)種細胞類型,生(shēng)态環境,生(shēng)理狀态而有所不同。葉綠體由葉綠體外被(chloroplast envelope)、類囊體(thylakoid)和基質(stroma)三部分組成,含有3種不同的膜:外膜、内膜、類囊體膜和3種彼此分開(kāi)的腔:膜間隙、基質和類囊體腔。本公司的植物(wù)葉綠體提取試劑盒采用密度梯度離心方法,可以從(cóng)多(duō)種植物(wù)中提取高(gāo)純度的葉綠體。
1.
即用型試劑盒,用戶不需要單獨配制各種溶液。
2.
不需要液氮研磨葉片,可以從(cóng)50-100
mg材料中提取葉綠體,方便使用。
3.
試劑盒可以用于葉綠體粗提,所得葉綠體含少量其他細胞器(qì)污染,可用于後續的SDS-PAGE,Western,ELISA和蛋白(bái)組分析。也可以用于葉綠體精提,所得葉綠體完整,可用于後續的光(guāng)合作用,電(diàn)子鏈和磷酸化,跨膜轉運,體外葉綠體蛋白(bái)合成,蛋白(bái)定位等研究。還(hái)可用于葉綠體膜,基質,類囊體的提取以及葉綠體DNA和葉綠體RNA純化。
4.
以每次處理0.1
g葉片計算(suàn),本産品可使用50次提取,每次能(néng)得到(dào)20-30
μg葉綠體(葉綠素定量)。
5.
已經成功用于拟南(nán)芥,綠蘿,菠菜,大豆,莴筍,白(bái)菜,煙(yān)草(cǎo)和甜菜等植物(wù),還(hái)可用于更多(duō)植物(wù)(可能(néng)需要優化條件(jiàn))。
注:本産品适合于少量葉片(50-100 mg)葉綠體的提取,大量葉片葉綠體提取(每次處理30
g葉片)請選擇RTU5001
植物(wù)葉綠體提取試劑盒。
● 貯存及運輸:
4-8℃保存;有效期一(yī)年(nián);試劑盒常溫運輸。
● 産品組成:
|
産品貨号
|
産品名稱
|
包裝
|
貯存
|
|
RTU5004-01
|
提取緩沖液
|
25
ml
|
4-8℃
|
|
RTU5004-02
|
漂洗緩沖液
|
100
ml
|
4-8℃
|
|
RTU5004-03
|
密度梯度分離試劑
|
20
ml
|
4-8℃
|
|
CD-50
|
離心柱套裝(包含離心柱和2 ml連蓋收集管)
|
50套
|
RT
|
|
YMB-5
|
塑料研磨棒
|
5根/包
|
RT
|
|
|
說明書
|
一(yī)份
|
-
|
● 使用說明:
注意:葉綠體對溫度高(gāo)度敏感,所以整個(gè)操作必須在冰上(shàng)或者在冷室進行,所用器(qì)皿和溶液均需要在4℃預冷。離心時一(yī)定要在4℃進行,離心力以g而不是rpm計算(suàn)。如果需要研究葉綠體的功能(néng),提取過程還(hái)需要在昏暗(àn)的光(guāng)線條件(jiàn)下(xià)進行。
需要自(zì)備材料:
剪刀;1.5 離心管;低(dī)溫離心機(jī)。
一(yī) 葉綠體提取:
1.1 材料預處理:
實驗前1-2天将植物(wù)放(fàng)在暗(àn)室培養以減少葉綠體中澱粉顆粒的形成,否則離心時這些顆粒很容易使葉綠體破裂。葉片在實驗前需先用自(zì)來水(shuǐ)洗淨,再用蒸餾水(shuǐ)淋洗,去掉多(duō)餘水(shuǐ)分。如果葉片采集後不能(néng)立即處理,則保存時需要保持葉片濕潤,即使如此,葉片采集後的放(fàng)置時間也不能(néng)超過一(yī)天。
1.2 葉片研磨:
1.2.1 取50-100 mg新鮮采集植物(wù)樣品(葉片,軟莖等),剪成1-3 cm2大小(xiǎo)的碎片放(fàng)入離心柱内。
注:樣品質量盡量控制在100 mg以内,有利于後續充分研磨。
1.2.2 加入0.1 ml 預冷的提取緩沖液,用塑料研磨棒向下(xià)擠壓旋轉研磨樣品20-30次(大約用時1-2分鍾),至樣品無可見(jiàn)大塊組織碎片,再補加0.3 ml 提取緩沖液,用吸頭混勻。
注:塑料研磨棒可以水(shuǐ)洗後重複使用。
1.3 離心去雜(zá)質:
蓋好2 ml收集管管蓋,4℃ 2000 g(約4600 rpm)離心 5分鍾。
1.4 粗葉綠體提取:
1.4.1 棄離心柱,吸頭吸棄離心管内上(shàng)清,保留沉澱。
注:如沉澱離心後不實,可以重懸沉澱後再次離心收集沉澱。
1.4.2 沉澱中加入0.1 ml漂洗緩沖液,輕輕重懸,溶液即為(wèi)葉綠體粗提液。
注:100 mg葉片提取的粗葉綠體,溶于0.1
ml漂洗緩沖液中,葉綠體濃度約為(wèi)0.6-1
μg Chl/μl(葉綠體濃度測定見(jiàn)步驟1.6),可以将多(duō)管葉綠體溶液4℃ 4200 g 離心5分鍾,合并葉綠體沉澱,用漂洗緩沖液将葉綠體濃度調整為(wèi) 1 μg Chl/μl(1 mg Chl/ml),分裝為(wèi)50
μl每隻,-80℃貯存。
1.5 精制葉綠體提取:
1.5.1即用型梯度分離液配制:
在幹淨的1.5 ml離心管中加入0.4 ml 密度梯度分離試劑和0.6
ml漂洗緩沖液,渦旋徹底混勻。
1.5.2 将步驟1.4.2的0.1 ml葉綠體粗提液緩慢(màn)加入到(dào)即用型梯度分離液上(shàng)方。
1.5.3 4℃ 4200 g(約6600 rpm)離心10分鍾,小(xiǎo)心棄上(shàng)清,沉澱為(wèi)精制葉綠體。
1.5.4 在沉澱中加入0.5 ml 漂洗緩沖液,輕柔重懸沉澱。
1.5.5 4℃ 4200 g(約6600 rpm)離心5分鍾,棄上(shàng)清,保留沉澱。
1.5.6沉澱中加入0.1 ml漂洗緩沖液,輕輕重懸,溶液即為(wèi)精制葉綠體。
注:100
mg葉片提取的精制葉綠體,溶于0.1
ml漂洗緩沖液中,葉綠體濃度約為(wèi)0.3-0.7
μg Chl/μl(葉綠體濃度測定見(jiàn)步驟1.6),可以将多(duō)管葉綠體溶液4℃ 4200 g 離心5分鍾,合并葉綠體沉澱,用漂洗緩沖液将葉綠體濃度調整為(wèi) 1 μg Chl/μl(1 mg Chl/ml),分裝為(wèi)50
μl每隻,-80℃貯存。
1.6 葉綠素含量測定:
通(tōng)常葉綠體含量用單位葉綠素(Chl)含量來表示,即x
mg Chl/ml 葉綠體懸浮液。
1.6.1 取10 μl 葉綠體懸浮液加入到(dào)990
μl 95%乙醇溶液中,混勻。
1.6.2測定OD649和OD665 吸光(guāng)值,用95%乙醇做空白(bái)對照(zhào)。
1.6.3 根據以下(xià)公式計算(suàn)葉綠素:
葉綠素濃度(mg/ml)=100×(18.16×OD649+6.63×OD665)
100:稀釋倍數
二. 葉綠體的使用:
2.1 葉綠體功能(néng)研究:
如果用于完整葉綠體的功能(néng)或酶活性研究,初始100 mg樣品分離得到(dào)的葉綠體樣品調整葉綠體濃度為(wèi)1 μg Chl/μl,50 μl/管分裝, -80℃貯存備用。不建議長(cháng)期貯存,盡快使用。
2.2 葉綠體蛋白(bái)電(diàn)泳:
2.2.1葉綠體蛋白(bái)變性樣品處理:
2.2.1.1 取50 μl葉綠體溶液(1 μg Chl/μl);
2.2.1.2 4℃ 4200g 離心5分鍾,棄上(shàng)清,沉澱中加入SDS-PAGE上(shàng)樣緩沖液(貨号:PL080,PL113,PL121)處理,建議調整上(shàng)樣液濃度為(wèi)0.5 μg/μl;對于多(duō)次跨膜蛋白(bái)(Multi-pass
membrane protein)的變性電(diàn)泳檢測,樣品建議使用37℃處理30分鍾,不要95℃加熱5分鍾,因為(wèi)在95℃高(gāo)溫情況下(xià),多(duō)次跨膜蛋白(bái)極易聚集形成多(duō)聚體,樣品會(huì)聚集,WB檢測會(huì)表現為(wèi)比實際蛋白(bái)大小(xiǎo)更大的分子量;
2.2.1.3 使用SDS-PAGE凝膠(貨号:RTD6132,RTD6116)電(diàn)泳,每個(gè)泳道上(shàng)樣10-40 μl(5-20 μg)。
2.2.2 葉綠體蛋白(bái)BN非變性樣品處理:
2.2.2.1取50 μl葉綠體溶液(1 μg Chl/μl);;
2.2.2.2 4℃ 4200g 離心5分鍾,棄上(shàng)清,沉澱中加入50 μl 類囊體膜增溶緩沖液,輕柔重懸沉澱,盡量不産生(shēng)氣泡,冰浴10分鍾;
2.2.2.3 4℃ 16000 g 10分鍾,取上(shàng)清至一(yī)幹淨1.5 ml離心管中即為(wèi)增溶後葉綠體蛋白(bái)溶液(小(xiǎo)心不要吸取沉澱),此時得到(dào)的葉綠體蛋白(bái)濃度為(wèi)1 μg/μl,其中去垢劑DDM(n-Dodecyl β-D-maltoside,β-DM, n-十二烷基-β-D-麥芽糖苷)終濃度為(wèi)2%;
2.2.2.4 葉綠體蛋白(bái)溶液中加入1/10體積類囊體膜上(shàng)樣緩沖液(10×),使用BN凝膠電(diàn)泳(貨号:RTD6139,RTD6140),每個(gè)泳道上(shàng)樣5-20 μg。
2.2.3 葉綠體蛋白(bái)等電(diàn)聚焦樣品處理(2D凝膠第一(yī)維電(diàn)泳):
建議葉綠體沉澱中使用溶解液:7 M尿素,2 M硫脲,2%CHAPS,20 mM DTT(自(zì)備,試劑盒不提供)。
三 實驗示例:
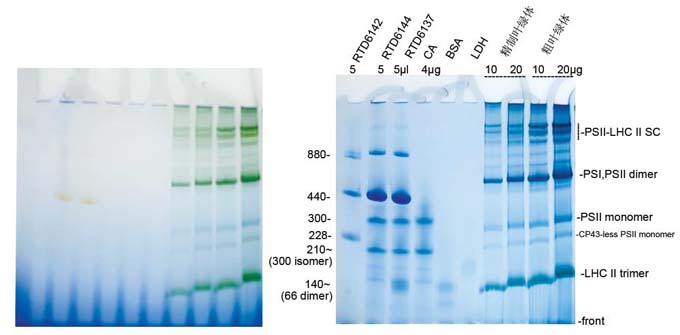
程序:取0.1克新鮮綠蘿葉片加入到(dào)離心柱内,加入0.1 ml提取緩沖液,研磨20次,再加入0.3
ml提取緩沖液(平行做6管);4度 2000g
離心5分鍾;棄上(shàng)清,沉澱中加入0.1ml漂洗緩沖液,合并6管得到(dào)0.6
ml粗葉綠體,保留0.2ml粗葉綠體。取0.1ml粗葉綠體加到(dào)1ml即用型梯度分離液上(shàng)層(0.4
ml密度梯度分離試劑加0.6ml漂洗緩沖液),平行做4管;4度 4200g
離心10分鍾,棄上(shàng)清,沉澱中加入0.5ml漂洗液清洗一(yī)次,4度 4200g
離心5分鍾,4管精制葉綠體沉澱合并收集于0.1ml漂洗液中。用乙醇方法測定葉綠體濃度,調整粗葉綠體和精制葉綠體濃度均為(wèi)1μg Chl/μl;取50μl葉綠體溶液,離心,沉澱中加入50
μl類囊體膜增溶緩沖液,冰浴10分鍾,4度
16000g 離心10分鍾取上(shàng)清,加入1/10體積類囊體膜上(shàng)樣緩沖液(10×),此時葉綠體蛋白(bái)濃度為(wèi)1μg/μl,上(shàng)樣10 μl和20 μl。
電(diàn)泳:RTD6138-0312 3-12%BN膠,1×BN
buffer+0.02%G-250,200V 15-3.5mA 50 min
更換1×無色BN buffer 200V繼續電(diàn)泳,時間共103
min,FastBlue蛋白(bái)染色液染色30分鍾。