動物(wù)線粒體提取試劑盒(細胞樣品)
(Animal Cell Mitochondria Isolation
Kit)
|
産品貨号
|
名稱
|
規格
|
|
RTD8115
|
動物(wù)細胞線粒體提取試劑盒(細胞樣品)
|
50次
|
● 産品簡介
動物(wù)細胞線粒體提取試劑盒(Animal
Cell Mitochondria Isolation Kit)可以快速便捷分離培養細胞的線粒體。試劑盒的緩沖系統不含任何表面活性劑和螯合劑EDTA,分離獲得的線粒體純度較高(gāo),并且絕大部分分離獲得的線粒體都含有完整的内膜和外膜,可以用于線粒體的生(shēng)理功能(néng)等方面的研究。另外,優化的裂解配方配套離心柱法有效裂解細胞,省去了經典方法使用玻璃勻漿器(qì)的繁瑣操作,更加省時省力。同時,本試劑盒在分離線粒體的同時可以獲得去除線粒體的細胞胞漿蛋白(bái),可以研究線粒體蛋白(bái)向胞漿内的運輸機(jī)制。
該産品約30分鍾即可完成培養細胞線粒體的提取。線粒體是在溫和、非變性條件(jiàn)下(xià)提取的,結合不同的溶解液,溶解後的線粒體可以用于SDS-PAGE變性電(diàn)泳檢測、Blue
Native非變性電(diàn)泳檢測以及等電(diàn)聚焦電(diàn)泳等。另外,提取的線粒體具有生(shēng)理功能(néng),可以用于線粒體的生(shēng)理功能(néng)等方面的研究。
按照(zhào)每次提取2×107細胞計算(suàn),試劑盒可以使用大約50次。
● 産品組成
|
産品編号
|
名稱
|
規格
|
貯存
|
|
RTD8115-01
|
分離緩沖液A
|
15 ml
|
-20℃
|
|
RTD8115-02
|
分離緩沖液B
|
15 ml
|
-20℃
|
|
RTD8115-03
|
漂洗緩沖液
|
30 ml
|
-20℃
|
|
RTD8115-04
|
貯存緩沖液
|
3 ml
|
-20℃
|
|
PS1020
|
變性蛋白(bái)溶解液
|
5 ml
|
RT
|
|
CD-50
|
離心柱套裝
(包含離心柱和2ml連蓋收集管)
|
50個(gè)
|
RT
|
|
|
|
|
|
|
|
說明書
|
|
|
● 貯存條件(jiàn)和運輸:
按照(zhào)标簽溫度貯存;有效期一(yī)年(nián);濕冰運輸。
● 用前必讀(dú):
1. 離心機(jī)請調整成RCF/g模式,按照(zhào)離心力設置離心機(jī)(不要根據轉速rpm模式設置),所有離心步驟都需要在4℃低(dī)溫離心機(jī)中進行。
2. 将分離緩沖液A,分離緩沖液B,漂洗緩沖液和貯存緩沖液混勻後放(fàng)置于冰上(shàng)。将離心柱套入2 ml連蓋收集管中,蓋好管蓋,放(fàng)置于冰上(shàng)預冷。
3. 蛋白(bái)提取推薦添加蛋白(bái)酶抑制劑(自(zì)備,試劑盒不提供),根據蛋白(bái)酶抑制劑母液濃度提前添加在膜蛋白(bái)提取溶液中(如抑制劑母液是 100×,添加時按照(zhào)1:100添加,即1ml膜蛋白(bái)提取溶液添加10μl抑制劑)。研究蛋白(bái)磷酸化,需要添加磷酸酶抑制劑(自(zì)備,試劑盒不提供)。
4.
蛋白(bái)定量推薦使用BCA方法,可以選擇BCA蛋白(bái)濃度測定試劑盒(貨号:RTP7102)。
● 使用方法:
一(yī). 準備溶液:
常溫溶解試劑盒中的各種溶液,溶解後立即置于冰上(shàng)并混勻。如果最終實驗目的是制備線粒體蛋白(bái)樣品,根據樣品數量,取适量體積分離緩沖液A加入蛋白(bái)酶抑制劑。按照(zhào)下(xià)表大體估算(suàn)分離緩沖液A的使用體積:
|
細胞類型
|
培養器(qì)皿
|
細胞數量
|
細胞沉澱體積(PCV)(μl)
|
分離緩沖液A(μl)
|
|
懸浮細胞
|
|
~2×107
|
~200
|
250
|
|
貼壁細胞
|
96孔闆
|
~1×105
|
調整細胞數目到(dào)2×107
|
250
|
|
24孔闆
|
~5×105
|
|
6孔闆
|
~2.5×106
|
|
25cm2培養瓶
|
~2×106
|
|
75cm2培養瓶
|
~8×106
|
|
35
mm培養皿
|
~2×106
|
|
60
mm培養皿
|
~5×106
|
|
100
mm培養皿
|
~1.5×107
|
注:(二百萬,2×106)HeLa細胞,其細胞沉澱體積(PCV,Packed Cell Volume)大約為(wèi)20 μl。
二. 收集細胞:
2.1
對于貼壁細胞:細胞用PBS漂洗一(yī)遍,棄PBS;再加入适量PBS,用細胞刮刀刮下(xià)細胞,或用0.02%
EDTA(0.5
mM)溶液處理細胞使細胞不再貼壁很緊,并用移液器(qì)吹打下(xià)細胞。400
g(~2000
rpm)
4℃離心5
min收集細胞,盡最大努力吸盡上(shàng)清,留下(xià)細胞沉澱備用。盡量避免用胰酶消化細胞,以免胰酶降解需提取的目的蛋白(bái)。
2.2
對于懸浮細胞:400
g(~2000
rpm)4℃離心5
min收集細胞,用PBS洗一(yī)遍,離心收集細胞,盡最大努力吸盡上(shàng)清,留下(xià)細胞沉澱備用。
三. 裂解細胞膜:
3.1細胞沉澱中加入250
μl準備好的分離緩沖液A(含蛋白(bái)酶抑制劑),用移液器(qì)吹打重懸細胞沉澱,渦旋劇烈震蕩30-60秒(miǎo),冰浴處理10分鍾,間歇2-3混勻。
注:建議将起始細胞數不要低(dī)于2×107,否則将導緻最後線粒體得率過低(dī)。
3.2
将細胞懸液轉移到(dào)離心柱中,蓋上(shàng)管蓋,16,000
g(~13000
rpm) 4℃離心1分鍾,離心後收集管底部會(huì)有沉澱形成。
注:離心柱最大體積為(wèi)600 μl;确保離心機(jī)可以在10秒(miǎo)内達到(dào)16000 g。
3.3 棄去離心柱,蓋好2
ml收集管管蓋,用1ml移液器(qì)輕柔吹打重懸收集管中的沉澱。
四. 去除細胞核和未破碎的細胞:
溶液700 g(~2700 rpm)
4℃離心1分鍾,用200
μl吸頭小(xiǎo)心将上(shàng)清(上(shàng)清稍有渾濁)轉移到(dào)新的1.5
ml離心管中。注意:轉速不要超過700g,否則會(huì)降低(dī)線粒體的得率。
關鍵步驟:吸取上(shàng)清時不要觸及沉澱,甚至可以丢棄部分上(shàng)清不吸取,以免上(shàng)清(含線粒體)中污染核蛋白(bái)。如果使用250 μl分離緩沖液A,建議吸取200 μl上(shàng)清。此步驟得到(dào)的細胞核純度不高(gāo),混雜(zá)有沒有完全破碎的完整細胞,不建議用于相(xiàng)關實驗。
五. 收集線粒體:
5.1
上(shàng)清中加入等體積的分離緩沖液B(如步驟4吸取200
μl上(shàng)清,則加入200
μl分離緩沖液B),混勻;
5.2
16000 g(~13000
rpm)
4℃離心10分鍾,用200
μl吸頭吸去上(shàng)清,沉澱即為(wèi)提取的線粒體。上(shàng)清是胞漿蛋白(bái),如需要可保存備用。
關鍵步驟:此步驟必須完全将上(shàng)清吸取幹淨,可以用200μl吸頭分次吸取上(shàng)清,最後用10 μl吸頭将殘餘上(shàng)清徹底吸淨,以免線粒體中污染胞漿蛋白(bái)。
六. 線粒體漂洗:
線粒體沉澱中加入0.5 ml 漂洗緩沖液,輕柔重懸沉澱,16,000 g,4℃離心5分鍾,棄上(shàng)清,沉澱即為(wèi)漂洗後的線粒體。
七. 線粒體的使用:
7.1 線粒體功能(néng)研究:
如果用于完整線粒體的功能(néng)或酶活性研究,初始2×107細胞分離得到(dào)的線粒體樣品中加入100-150
μl線粒體貯存緩沖液,重懸線粒體後-80℃備用。不建議長(cháng)期貯存,盡快使用。
7.2 線粒體蛋白(bái)電(diàn)泳:
7.2.1線粒體蛋白(bái)變性樣品處理:
7.2.1.1 初始2×107細胞分離得到(dào)的線粒體沉澱中建議使用50
μl變性蛋白(bái)溶解液(貨号:PS1020)溶解線粒體沉澱;
7.2.1.2
BCA方法測定蛋白(bái)濃度(貨号:RTP7102);
7.2.1.3用變性蛋白(bái)溶解液調整蛋白(bái)濃度為(wèi)1
μg/μl,按需分裝,每管50
μl,-80℃保存待用;
7.2.1.4取一(yī)管50
μl樣品加入SDS-PAGE上(shàng)樣緩沖液(貨号:PL080,PL113,PL121)處理,建議調整上(shàng)樣液濃度為(wèi)0.5
μg/μl;對于多(duō)次跨膜蛋白(bái)(Multi-pass
membrane protein)的變性電(diàn)泳檢測,樣品建議使用37℃處理30分鍾,不要95℃加熱5分鍾,因為(wèi)在95℃高(gāo)溫情況下(xià),多(duō)次跨膜蛋白(bái)極易聚集形成多(duō)聚體,樣品會(huì)聚集,WB檢測會(huì)表現為(wèi)比實際蛋白(bái)大小(xiǎo)更大的分子量;
7.2.1.5
使用SDS-PAGE凝膠(貨号:RTD6132,RTD6116)電(diàn)泳,每個(gè)泳道上(shàng)樣10-40
μl(5-20
μg)。
7.2.2 線粒體蛋白(bái)BN非變性樣品處理:
7.2.2.1 初始2×107細胞分離得到(dào)的線粒體沉澱中建議使用50
μl膜蛋白(bái)重懸液(BN電(diàn)泳用)(貨号:PN1020)重懸線粒體沉澱;
7.2.2.2
BCA方法測定蛋白(bái)濃度(貨号:RTP7102);
7.2.2.3 用膜蛋白(bái)重懸液(BN電(diàn)泳用)(貨号:PN1020)調整蛋白(bái)濃度為(wèi)1
μg/μl,按需分裝,每管50
μl,-80℃保存待用;
7.2.2.4
取一(yī)管50
μl樣品,溶化混勻後4℃
16000 g 5分鍾,去除上(shàng)清,保留沉澱;
7.2.2.5 沉澱中加入50
μl膜蛋白(bái)增溶液A(貨号:DM1080),輕柔重懸沉澱,盡量不産生(shēng)氣泡,冰浴10分鍾;
7.2.2.6 4℃
16000 g 15分鍾,取上(shàng)清至一(yī)幹淨1.5 ml離心管中即為(wèi)增溶後線粒體蛋白(bái)溶液(小(xiǎo)心不要吸取沉澱),此時得到(dào)的線粒體蛋白(bái)濃度為(wèi)1
μg/μl,其中去垢劑DDM(n-Dodecyl
β-D-maltoside,β-DM, n-十二烷基-β-D-麥芽糖苷)終濃度為(wèi)1%;
7.2.2.7 線粒體蛋白(bái)溶液中加入1/10體積10×膜蛋白(bái)A型上(shàng)樣緩沖液(配套膜蛋白(bái)增溶液A使用)(貨号:PL130),使用BN凝膠電(diàn)泳(貨号:RTD6139,RTD6140),每個(gè)泳道上(shàng)樣5-20
μg。
7.2.3 線粒體蛋白(bái)等電(diàn)聚焦樣品處理(2D凝膠第一(yī)維電(diàn)泳):
建議線粒體沉澱中使用溶解液:7
M尿素,2
M硫脲,
2%CHAPS,20 mM DTT(自(zì)備,試劑盒不提供)。
八 線粒體産量和質量的評價:
8.1 線粒體産量:
|
細胞系
|
細胞數量
|
線粒體蛋白(bái)
|
|
K562
|
2×107
|
100-150 μg
|
|
Jurkat
|
2×107
|
80-100 μg
|
|
Hela
|
2×107
|
100-150 μg
|
|
NIH-3T3
|
2×107
|
80-120 μg
|
8.2 線粒體質量評價:
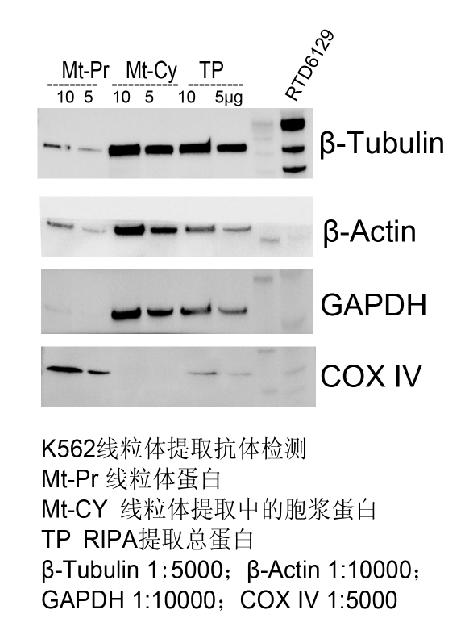
線粒體質量評價首先看(kàn)提取的線粒體是否具有完整的内外膜結構(進行線粒體功能(néng)活性研究),其次要看(kàn)裂解後的線粒體蛋白(bái)是否有明顯的富集,其三要看(kàn)裂解後的線粒體蛋白(bái)是否有其他組分交叉污染,最後看(kàn)提取的線粒體中是否可以檢測出目的蛋白(bái)。使用專門(mén)的線粒體内參檢測(下(xià)表),可以初步确認提出的是線粒體蛋白(bái)。線粒體蛋白(bái)是否有效富集需要用總蛋白(bái)作為(wèi)對照(zhào),與總蛋白(bái)相(xiàng)比,線粒體内參蛋白(bái)是否有明顯富集。線粒體蛋白(bái)中的交叉污染可以用其他組分内參檢測線粒體蛋白(bái)樣品,如關注線粒體蛋白(bái)中是否有胞漿蛋白(bái)污染,可以使用胞漿蛋白(bái)内參檢測線粒體蛋白(bái),檢測條帶的強弱即說明線粒體蛋白(bái)與胞漿蛋白(bái)交叉污染的程度。用目标蛋白(bái)抗體檢測線粒體蛋白(bái),驗證是否可以檢測到(dào)目的蛋白(bái),蛋白(bái)大小(xiǎo)是否符合預期。
|
位置
|
内參名稱
|
大小(xiǎo) kD
|
|
細胞膜
|
Na-K ATPase
|
100
|
|
内質網膜
|
Calnexin
|
~90
|
|
線粒體膜
|
COX IV
|
17
|
許多(duō)研究人員(yuán)利用
WB對分離的線粒體蛋白(bái)進行純度檢測,經常發現一(yī)些常用的胞漿内參能(néng)在線粒體蛋白(bái)中檢測到(dào),例如β-actin[1],
GAPDH [2] 和 β-tubulin,這是由于這些胞漿内參不僅存在于胞漿也存在于線粒體中,因此可以在線粒體蛋白(bái)中檢測到(dào)胞漿内參。更多(duō)信息,請參閱以下(xià)論文:
1
Hatch, Anna L., Pinar S. Gurel, and Henry N. Higgs. Novel roles for actin in
mitochondrial fission. Journal of Cell Science (2014) 127,
1–12
2
Zhang, Jin-Ying, et al. Critical
protein GAPDH and its regulatory mechanisms in cancer cells. Cancer
Biol Med 2015;12:10-22.
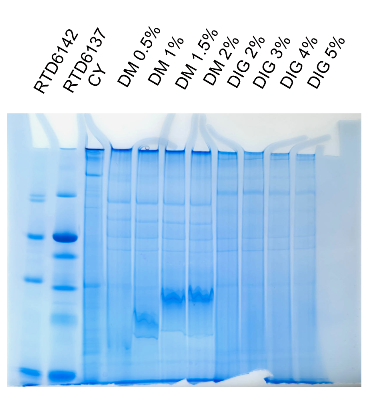
九 實驗示例:
不同去垢劑處理K562細胞線粒體3-12%BN電(diàn)泳