PAGE膠蛋白(bái)微量回收試劑盒(貨号:RTD8108)
● 試劑盒組成:
|
組份貨号
|
試劑盒組成
|
規格
|
貯存
|
|
RTD8108-01
|
溶液A-洗脫液
|
10 ml
|
4-8℃
|
|
RTD8108-02
|
溶液B-助沉液
|
5 ml
|
4-8℃
|
|
RTD8108-03
|
溶液C-沉澱液
|
10 ml
|
4-8℃
|
|
DT0140P-01
|
1 M DTT(粉末)
|
1 ml
|
4-8℃
配制溶液後-20℃貯存
|
|
CF-20
|
過濾柱
|
20套/包
|
RT
|
|
YMC07-5
|
塑料研磨杵
|
5個(gè)/包
|
RT
|
|
|
說明書
|
1份
|
|
● 運輸、儲存條件(jiàn)和效期:
常溫運輸,标簽溫度保存,有效期為(wèi)一(yī)年(nián)。
● 産品簡介及使用說明:
蛋白(bái)電(diàn)泳不僅可用于檢測蛋白(bái)質的相(xiàng)對分子質量,而且也是分離純化蛋白(bái)質的重要工(gōng)具之一(yī),随著(zhe)蛋白(bái)質技(jì)術(shù)的微量化,有必要從(cóng)凝膠中回收蛋白(bái)質以用于制備抗體、免疫印迹、氨基酸組分分析或末端序列測定等,本産品就(jiù)是專門(mén)為(wèi)此用途開(kāi)發的微量蛋白(bái)膠回收法,回收效率在50-80%。
按照(zhào)每次使用400 μl 溶液A計算(suàn),試劑盒至少可以使用20 次。
● 使用方法:
1. 電(diàn)泳:
按常規方法進行變性(SDS-PAGE)或非變性蛋白(bái)電(diàn)泳(Native-PAGE)。
2. 切膠:
2.1 用手術(shù)刀片将銅染(貨号:RTD6207)或鋅染(貨号:RTD6206)的膠塊中含有目的條帶的部分膠切下(xià)(盡可能(néng)地把多(duō)餘的膠切除,否則會(huì)影響回收效率),放(fàng)入1.5 ml的離心管中,用相(xiàng)應的消除液将膠中蛋白(bái)質條帶脫色到(dào)膠體接近無色透明,超純水(shuǐ)漂洗凝膠兩次,保留膠體進行步驟3。
2.2 由于考馬斯亮藍染色蛋白(bái)的特殊性,不建議考染後進行切膠操作。建議把樣品分多(duō)孔上(shàng)樣,電(diàn)泳後隻切其中一(yī)個(gè)膠孔的膠條進行染色,然後将此膠條放(fàng)回到(dào)在整體膠中原來的位置,通(tōng)過顯色膠條上(shàng)的蛋白(bái)條帶找到(dào)在未染色膠上(shàng)對應區域,并切下(xià)膠體進行步驟3。
2.3 如不進行染色,可以使用預染Marker判斷目的蛋白(bái)的位置進行切膠進行步驟3。但此方法缺點在于蛋白(bái)的位置難以精确判斷。
3. 研磨處理:
3.1 稱取1.5 ml離心管中膠塊重量;用研磨杵充分将膠塊壓磨成盡可能(néng)細小(xiǎo)的碎片。
3.2 即用型溶液A配制:
根據溶液A的使用量配制即用型溶液A的體積。配制比例為(wèi):1 ml溶液A加入10 μl 1 M DTT溶液。
3.3根據膠塊重量加入即用型溶液A,用研磨杵再次充分研磨,4℃搖床慢(màn)搖洗脫過夜(12-16小(xiǎo)時)。
注:膠塊重量和即用型溶液A體積大體按照(zhào)1:4比例加入,如膠塊100 mg加入400 μl即用型溶液A,溶液A使用量甯多(duō)勿少。洗脫時間與凝膠濃度,蛋白(bái)分子量大小(xiǎo)有關,膠濃度越高(gāo),分子量越大,洗脫時間越長(cháng)。
4. 過濾除膠:
用1 ml 的去尖吸頭吸取混合物(wù)至過濾柱中(過濾柱放(fàng)入收集管中),注意将碎膠一(yī)起吸入,溶液過多(duō)時可分次加入,12,000 rpm 離心2分鍾,保留收集管中的濾出液(包含蛋白(bái))。
5. 蛋白(bái)沉澱:
5.1 将濾出液轉移到(dào)1.5 ml離心管中,加入1/10體積的溶液B-助沉液,混勻,常溫放(fàng)置15 min。
5.2 加入步驟5.1溶液1/4體積的溶液C-沉澱液,充分混勻後,冰浴15 min。
注:加入溶液C後溶液變渾濁,需要徹底充分混勻。
5.3 4℃ 12,000
rpm離心10分鍾,去除上(shàng)清,保留蛋白(bái)沉澱。
注:由于溶液B-助沉液的作用,此步驟得到(dào)管底很明顯的蛋白(bái)沉澱物(wù)。
6. 蛋白(bái)漂洗:
6.1 蛋白(bái)沉澱中加入1 ml預冷的丙酮(自(zì)備,試劑盒不提供),徹底重懸沉澱,混勻,冰浴放(fàng)置15 min。
6.2 4℃ 12,000 rpm離心10分鍾,去除上(shàng)清,保留沉澱。
注:通(tōng)過丙酮的漂洗,去除步驟5.3中蛋白(bái)沉澱中的非蛋白(bái)組份。
6.3 離心管快甩離心,用10 μl吸頭将離心管中殘餘溶液徹底吸淨,常溫開(kāi)口風幹1-2分鍾,待殘留的液體揮發幹淨。
7. 蛋白(bái)貯存:
選用合适的緩沖液溶解沉澱的蛋白(bái)質,以方便進行後續的電(diàn)泳和質譜測序等實驗。
實驗示例:
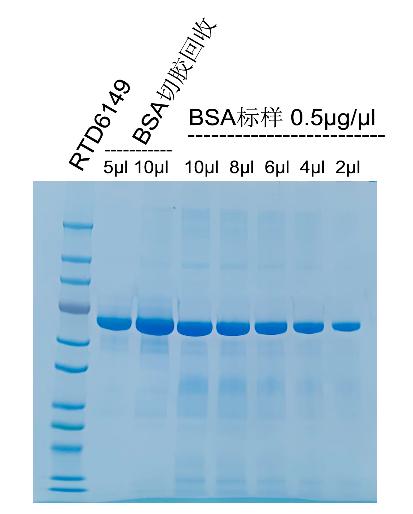
鋅染後BSA切膠回收
40μl (20μg)BSA(0.5μg/μl)上(shàng)樣,鋅染後
切膠回收,最後溶于40μl上(shàng)樣緩沖液中
上(shàng)樣5μl和10μl。回收效率高(gāo)于90%。